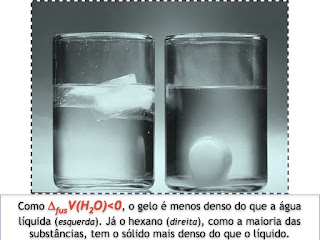
Um dos mais leves dos gases, mas que tem um líquido extremamente denso; mais denso mesmo do que o seu seu próprio sólido. Dentre as anomalias da água, um destaque é o fato bizarro de que seu sólido (o gelo) é MENOS DENSO do que o líquido. Isto é: o líquido se expande ao congelar.
Como comparação, veja o argônio, que neste quisito tem um comportamento parecido com o da maioria das substâncias: ao congelar, seu volume DIMINUI em 13%. Com a água, é o contrário: o volume, durante a solidificação, AUMENTA 9%.
Aqui, você vai entender a razão deste desvio comportamental da água.
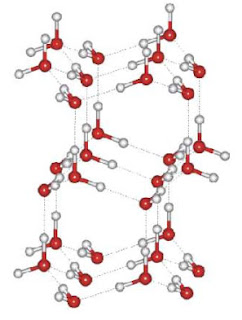
Moléculas de água no gelo
Moléculas de água no líquido
Tudo ocorre devido, mais uma vez, ao número e à magnitude da força das ligações intermoleculares que as moléculas de água podem fazer. No sólido ordinário (IceI), cada molécula de água ocupa uma posição relativamente definida, com baixíssima mobilidade, e faz 4 ligações hidrogênio com suas vizinhas (2 como doadoras e 2 como aceptoras), num arranjo tetraédrico. Cada ligação tem cerca de 200 pm de distância. Isto confere uma baixa eficácia no empacotamento destas moléculas, oferecendo uma estrutura bastante aberta.
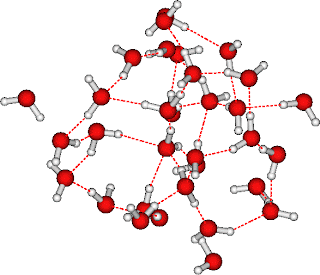
Já no estado líquido, como as moléculas possuem um alto coeficiente de difusão (0,227 m2.s-1), elas não fazem 4 ligações simultâneas. Justamente esta é uma das razões do alto ponto de fusão e da alta entalpia de fusão da água, quando comparada a outras moléculas de tamanho ou massa similar. Como são pequenas e possuem apenas 3 átomos, boa parte da energia cinética das moléculas de água no líquido é exibida sob a forma de movimento translacional. E, por isso, mesmo a temperatura ambiente, cada molécula de água percorre, em média, cerca de 5 Ångstroem em apenas 1 nanosegundo (isto é, 50 cm em 1 s). Para isso, a molécula de água troca de parceiros o tempo todo - diz-se que faz ligações promíscuas com outras moléculas. O resultado é que, justamente por fazer ligações mais irregulares, desbalanceadas e de curta duração, o empacotamento das moléculas é maior e a distância média das ligações hidrogênio cai para menos de 180 pm.
O resultado, portanto, é uma variação negativa no volume de fusão: o sólido se contrai ao fundir!
Fonte: FalaQuímica
Nenhum comentário:
Postar um comentário